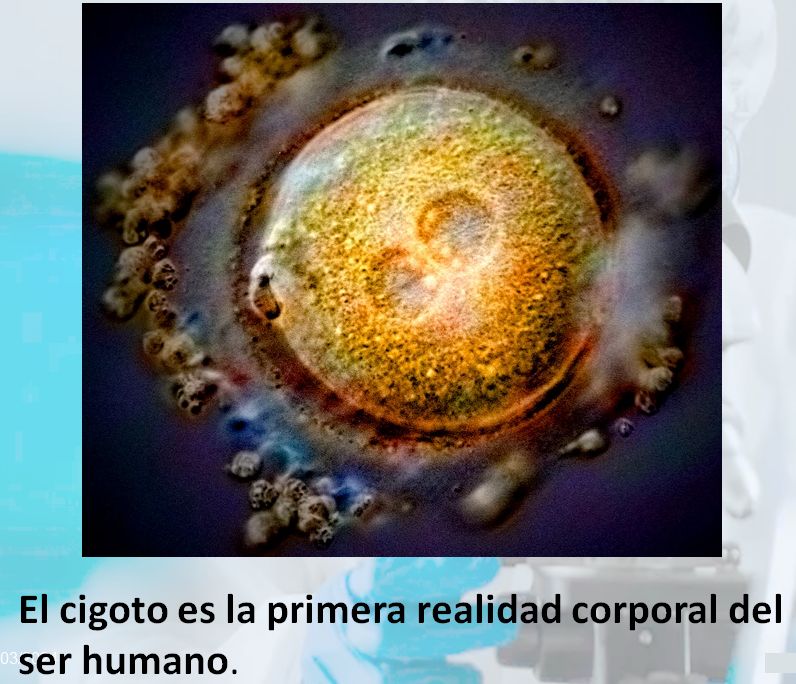
La edición genómica: entre el progreso médico y la deshumanización.

Fallece Carlo Casini, fundador del Movimiento por la Vida italiano y la Federación One of Us.
24/03/2020
No hay fronteras, no hay confines, solo Dios es mi bastión.
27/03/2020 Por Nicolás Jouve, presidente de CiViCa. Catedrático Emérito de Genética. Publicado en Actuall, el 24 de marzo de 2020.
Por Nicolás Jouve, presidente de CiViCa. Catedrático Emérito de Genética. Publicado en Actuall, el 24 de marzo de 2020.
La edición genómica es un apartado de la Biotecnología para la manipulación genética, que consiste en ejercer cambios directos en el ADN. Supone un nuevo desafío a las normas éticas que deben primar en la investigación biomédica y provoca un temor fundamentado en sus consecuencias.
La edición genómica representa un desafío ético científico.
La edición genómica es la última incorporación tecnológica al servicio de la modificación de la información genética y, en su aplicación al hombre, se puede utilizar con fines positivos y terapéuticos, pero también para intentar cambiar la información del ADN con otros fines. Es un nuevo modo de Ingeniería Genética, un apartado de la Biotecnología para la manipulación genética, que consiste en una manipulación directa del ADN, con mayor precisión que ninguna otra técnica utilizada anteriormente.
Se trata de una tecnología reciente, que está teniendo un crecimiento exponencial en los últimos años y que ha desplazado otros métodos más complejos y menos efectivos. Como comentamos en anteriores artículos su origen se basa en un magnífico descubrimiento del microbiólogo ilicitano Francisco Juan Martínez Mojica, en unos microorganismos que habitan en las salinas de Santa Pola, de unas regiones del genoma de unas secuencias cortas de ADN, palindrómicas, repetidas regularmente e interespaciadas, a las que dio el nombre de CRISPR. Estas secuencias repetidas, en combinación con una enzima llamada Cas9, constituyen un sistema natural por el que las bacterias pueden eliminar un ADN invasor, tras reconocerlo por la secuencia de las bases de la molécula.
El conocimiento adquirido a través de los proyectos genoma haría posible el diseño y síntesis artificial de sistemas moleculares como los bacterianos que permitirían localizar cualquier región de ADN que se deseara ya no destruir, sino modificar. De este modo nació el sistema CRISPR–Cas9 que funciona de modo similar que en las bacterias y se trata de aplicar para “editar”, corregir, cualquier región del ADN que reúna determinadas características.
En su aplicación en Medicina se persiguen fines clínicos. La realización de las operaciones de la terapia génica se realiza ex vivo, en células extraídas de los pacientes, con el fin de restaurar o implantar una modificación que corrija el defecto genético de estas células, que, tras demostrar la eficacia de la modificación son devueltas al sujeto con el fin de mejorar su condición o patología.
La edición génica ha encontrado su principal campo de aplicación en la terapia contra el cáncer
En el momento presente, hay varios protocolos de terapia génica de enfermedades monogénicas en células de tejidos somáticos, que son los que hasta el momento permiten su implantación o modificación en el genoma con un éxito más o menos limitado.
Además de otras aplicaciones, la edición génica ha encontrado su principal campo de aplicación en la terapia contra el cáncer. Se trata de fortalecer el sistema inmunitario del paciente mediante la edición génica de sus células de defensa. De este modo, ya se han obtenido unos resultados satisfactorios de modificación de linfocitos T de ratones de experimentación mediante el sistema CRISPR–Cas9.
Lo que se ha hecho es editar los genes que codifican unas proteínas receptoras de antígenos llamadas CARs –Chimeric Antigen Receptors– en células T del sistema inmunológico. Con ello, se trata de que la proteína receptora antigénica CAR se exprese de forma constitutiva en las células T, que quedan capacitadas para reconocer y atacar a las células cancerígenas que expresan los correspondientes antígenos. Las células CAR–T, resultantes de la edición génica son resistentes a las células tumorales. El primer CAR–T que se llevó a cabo en Estados Unidos fue el CAR–T anti-D19 para curar una leucemia linfoblástica aguda de tipo B infantil, operación que liberó a una niña en 2012. Desde entonces es una niña sana que lleva una vida normal. Este es el camino a seguir.
Además del cáncer, la edición genómica con la técnica CRISPR–Cas9 supone un nuevo modo de atacar enfermedades genéticas raras u otras no tan raras, pero sí graves, como la anemia falciforme, la fibrosis quística, la hemofilia B, la mucopolisacaridosis, la enfermedad de Huntington y otras muchas patologías que desde hace años se diagnostican bien, pero carecen de terapias adecuadas. Todas estas enfermedades se caracterizan por tener en común una región alterada del ADN de algún gen, normalmente por una modificación puntual de sus bases nucleotídicas.
Sin embargo, hay que ser comedidos en las expectativas. Todo esto está empezando, existiendo aún muchas dificultades técnicas a vencer por varias razones: no existen garantías del 100% de edición de genes; no hay seguridad respecto al lugar de modificación del ADN (la diana terapéutica) en el genoma receptor; la dificultad es total en caso el de enfermedades complejas, “sistemas multigénicos”, etc.
Una terapia génica in útero, segura, eficaz y curativa, sería una opción ética para las personas que no desean abortar
No obstante, hay un campo nuevo, magnifico, para llevar cabo una terapia génica prenatal, in útero, ya no solo de terapia génica, sino de edición génica. En los últimos años se intenta aplicar estas técnicas en la etapa fetal, es decir en el nasciturus, al que por medio de diagnóstico genético prenatal se hubiera detectado una enfermedad genética debida a un gen defectuoso. La gran noticia es que es un procedimiento completamente ético, al descartar la vía de la interrupción del embarazo mediante un aborto inducido.
La posibilidad de editar genes en la etapa prenatal aporta enormes ventajas, tanto éticas como terapéuticas, como son: una corrección temprana, lo que puede evitar procesos patológicos irreversibles: «es mejor prevenir que curar»; en el feto, debido a su proceso de desarrollo hay ambiente ideal por la abundancia de células madre, en los que los elementos moleculares a administrar pueden integrarse de forma más eficiente; el sistema inmune del nasciturus no está tan desarrollado y tolera mejor dichos elementos y proteínas para la terapia prenatal, que después del nacimiento; los grandes avances en la tecnología de captación de imágenes, a través de guías ecográficas, facilita una intervención sobre los tejidos somáticos del feto mínimamente invasivos, etc.
Muchas de las posibilidades de la terapia génica postnatal podrían ser ya realizadas antes del nacimiento, con las ventajas de atacar la patología en una fase más temprana del desarrollo. Es una esperanza. De momento ya ha habido varios éxitos en ensayos con modelos animales, aunque la inmadurez de la tecnología obliga a estudiar caso por caso.
Una terapia génica in útero, segura, eficaz y curativa, sería una opción ética para las personas que no desean abortar. Por ello, se está promoviendo fomentar la investigación hacia esta meta, lo que podría además potenciar la terapia génica postnatal, al proporcionar conocimientos sobre los problemas asociados con las células madre y el rechazo inmunológico tras el nacimiento.
Hasta aquí, las perspectivas positivas, con todas sus esperanzas y dificultades, pero con una línea bien definida a seguir, que se irá despejando y enriqueciendo a medida que la edición génica gane en precisión y seguridad. En la Web ClinicalTrials.org, se registran en el momento presente más de 30 ensayos clínicos, la mayoría para atacar diversos tipos de cáncer.
Incertidumbres bioéticas
Veamos ahora, siguiera brevemente las incertidumbres bioéticas. Si bien, no existen objeciones a las aplicaciones de la edición génica en células somáticas como las que se relacionan con las patologías en los pacientes ya nacidos o con los órganos en formación en la etapa prenatal, no es lo mismo, si lo que se desea hacer es la edición en algún gen con fines diferentes a los de curar una enfermedad. El “mejoramiento”, no especialmente con fines curativos, es la ensoñación de los “transhumanistas”, que piensan que se puede aplicar la edición génica en la “línea germinal”. Es decir, en los tejidos de los que proceden los gametos. El uso de este tipo de células constituye una preocupación creciente en el campo de la biotecnología por las razones que veremos a continuación. Para tranquilidad, de momento no hay ningún ensayo en marcha de este tipo de aplicaciones. Pero sí, intentos y antecedentes preocupantes.
En 2015 se abrió un gran debate tras publicarse en abril el trabajo de unos investigadores chinos que editaron genes en embriones humanos. En un embrión, procedente de la fecundación in vitro. aún no se han diferenciado los tejidos, y cualquier modificación puede afectar a las células del futuro tejido germinal. En aquella ocasión los investigadores trataron de modificar el gen que codifica la b-globina de la sangre en embriones humanos no viables. Se trataba de embriones tripronuleares por haberse producido una doble penetración de dos núcleos de espermatozoides en el óvulo. Los resultados fueron muy negativos ya que los embriones derivados en algunos casos mostraban mosaicismo e inserciones erróneas en lugares distintos al del gen. Por esto, y por razones éticas, se recomendó una moratoria en este tipo de experimentos hasta el afinamiento de la técnica.
¿Quién detendrá a quienes no pretendan corregir una patología o curar una enfermedad, sino cambiar algún rasgo físico o de otra naturaleza dependiente de los genes?
Un año después, otros investigadores de la Universidad Guangzhou de China publicaban un segundo trabajo de edición génica en embriones. Se pretendía con ello provocar un efecto semejante al de la mutación natural CCR5D32 que poseen algunas personas que son resistentes al virus VIH del SIDA. La mutación altera la proteína CCR5 de manera que impide que el virus entre en las células T que intenta infectar. Los resultados fueron poco alentadores.
Otro hecho que provocó un debate bioético, fue la noticia de que en febrero de 2016 un equipo de investigadores del Instituto Francis Crick de Londres, había obtenido permiso de la Human Fertilisation and Embryology Authority –HFEA–, del Reino Unido para modificar el genoma de embriones humanos con fines de investigación básica. A diferencia de los intentos de los investigadores chinos en este caso se trataba de modificar embriones viables, con la condición de que los embriones manipulados fueran destruidos antes de 14 días. Como objeción al uso de los embriones humanos para este objetivo concreto, hay que señalar que todos los mamíferos tienen un desarrollo embrionario similar, regulado por los mismos genes ortólogos. La investigación se habría podido llevar a cabo en embriones de ratón con similares resultados.
También se han hecho experiencias de modificación genética en embriones con el fin de corregir genes alterados implicados en enfermedades. Este es el caso de un trabajo llevado a cabo por los equipos de Sukrat Mitalipov, de la Universidad de Oregón, y Juan Carlos Izpisua Belmonte, del Instituto Salk de Estudios Biológicos en La Jolla en California, que trataron de editar una mutación de un gen causante de una cardiomiopatía hipertrófica. El resultado publicado, reveló que entre los embriones descendientes del tratamiento hubo una cierta proporción que mostró la corrección, pero también hubo otros no modificados y algunos con mosaicismo. A pesar del optimismo de los autores, ni la eficacia, ni la exactitud, ni la seguridad ofrecen garantías para la utilización de este método para la corrección de mutaciones hereditarias en embriones humanos, lo que en cualquier caso requerirá la realización de un diagnóstico genético preimplantatorio posterior. La técnica adolece de una doble manipulación de las células germinales, y también un doble motivo de reparos éticos. Tampoco es de desestimar la posibilidad de modificaciones epigenéticas en unos embriones que sufren tanta manipulación, la edición genómica, la fecundación in vitro y el diagnóstico genético preimplantatorio.
En diciembre de 2015, el Dr. David Baltimore, presidente honorario del California Institute of Technology y Premio Nobel de Medicina en 1975, afirmó: «Antes de aceptar cualquier intento de aplicación de ingeniería genética humana, incluso para uso clínico, deben ser profusamente investigadas y entendidas a fondo la seguridad y la eficacia potencial de esta tecnología (CRISPR-Cas9)».
CRISPR-Cas9 supone un nuevo desafío a las normas éticas que deben primar en la investigación biomédica y provoca un temor fundamentado en las consecuencias para futuras generaciones. La realización de cambios de genes en las células somáticas puede tener sus efectos incluso negativos, pero sea el que sea el cambio producido no trascienden a la generación siguiente, por lo que entran en la categoría de terapia génica, con los mismos riesgos y potencial favorable de cualquiera de las tecnologías anteriores. Sin embargo, los cambios en las células de la línea germinal, generadoras de los gametos que resultasen desfavorables podrían trascender a la descendencia y por tanto a futuras generaciones.
Dejamos a un lado la imprudencia del investigador He Jiankui, de la Universidad de Shenzhen, en China, que en noviembre de 2018 dio a conocer el nacimiento de las niñas gemelas Lulu y Nana, a partir de unos embriones en los que había llevado a cabo una operación de edición genética para modificar un gen. Hoy paga las consecuencias con la cárcel, mientras que las niñas no quedan exentas de cambios en el genoma de consecuencias desconocidas en su futuro, y en sus potenciales descendientes.
En resumen, las razones para el rechazo de la utilización de los embriones como modo de modificar las condiciones físicas, fisiológicas, intelectuales, etc., que propugnan los transhumanistas, siguen siendo las mismas y a ello debe haber una fuerte oposición: La modificación genética en embriones humanos, contraviene los principios establecidos en el Convenio de Oviedo de 1997 sobre los derechos humanos y la biomedicina, en cuyo Art. 13 se declara que: «No podrá realizarse intervención alguna en el genoma humano si no es con fines preventivos, terapéuticos o diagnósticos, y a condición de que no tenga por objeto introducir ninguna modificación en el genoma de la descendencia».
En los casos citados no se trata de utilizar la modificación genética para beneficio del embrión. Ni siquiera se pretende conservar su vida. ¿Quién detendrá a quienes no pretendan corregir una patología o curar una enfermedad, sino cambiar algún rasgo físico o de otra naturaleza dependiente de los genes? Este es el debate que queda abierto, pero del que habrá que empezar a preocuparse.
Es necesario mantenerse firmes en el grito de Asilomar: «No todo lo científicamente posible es éticamente aceptable». El filósofo alemán Hans Jonas (1903-1993) ha reflexionado sobre la responsabilidad del quehacer científico y ha denunciado el hecho de que la ciencia actual se caracteriza por una capacidad creciente de abordar cualquier tema, pero también por una confusión sobre los fines de las investigaciones. El ser humano, señala Jonas, ha aumentado su poder dominador de la naturaleza, pero no se ha preocupado por crecer con la misma intensidad en el conocimiento de las consecuencias de ese poder.