Nature.- Seis meses de coronavirus: los misterios que los científicos aún intentan resolver.

Un 30% menos de personas con síndrome de Down nacidos en el Reino Unido como consecuencia de su eliminación por aborto inducido
20/08/2020
Se aplica una terapia con CRISPR por primera vez directamente en el cuerpo para el tratamiento de una ceguera
30/08/2020Por Ewen Callaway, Heidi Ledford y Smriti Mallapaty. Publicado en Nature. 583 , 178-179 (2020). doi: 10.1038 / d41586-020-01989-z
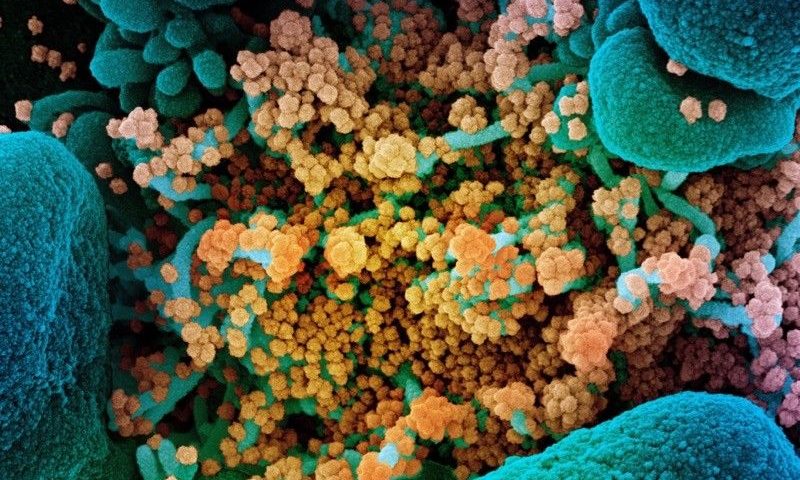
Imagen de portada: Una imagen de microscopio electrónico de barrido de partículas de coronavirus SARS-CoV-2 (naranja) en una celula (azul). Crédito: NIAID / NIH / SPL.
Desde la inmunidad hasta el papel de la genética, Nature analiza cinco preguntas urgentes sobre COVID-19 que los investigadores están abordando.
A fines de diciembre de 2019, surgieron informes de una misteriosa neumonía en Wuhan, China, una ciudad de 11 millones de personas en la provincia sureste de Hubei. La causa, determinaron rápidamente los científicos chinos, fue un nuevo coronavirus relacionado lejanamente con el virus del SARS que había surgido en China en 2003, antes de propagarse a nivel mundial y matar a casi 800 personas.
Seis meses y más de diez millones de casos confirmados después, la pandemia  de COVID-19 se ha convertido en la peor crisis de salud pública en un siglo. Más de 500.000 personas han muerto en todo el mundo. También ha catalizado una revolución en la investigación, ya que científicos, médicos y otros académicos han trabajado a una velocidad vertiginosa para comprender el COVID-19 y el virus que lo causa: el SARS-CoV-2.
de COVID-19 se ha convertido en la peor crisis de salud pública en un siglo. Más de 500.000 personas han muerto en todo el mundo. También ha catalizado una revolución en la investigación, ya que científicos, médicos y otros académicos han trabajado a una velocidad vertiginosa para comprender el COVID-19 y el virus que lo causa: el SARS-CoV-2.
¿Cómo es de mortal el coronavirus? Los científicos están cerca de una respuesta
Han aprendido cómo el virus entra y secuestra las células , cómo algunas personas lo combaten y cómo finalmente mata a otras . Han identificado medicamentos que benefician a los pacientes más enfermos y se están trabajando muchos más tratamientos potenciales. Han desarrollado cerca de 200 posibles vacunas , la primera de las cuales podría resultar eficaz a finales de año.
Pero por cada conocimiento sobre COVID-19, surgen más preguntas y otras persisten. Así es como funciona la ciencia. Para marcar los seis meses desde que el mundo se enteró por primera vez de la enfermedad responsable de la pandemia, Nature repasa algunas de las preguntas clave para las que los investigadores aún no tienen respuesta.
¿Por qué la gente responde de manera tan diferente?
 Uno de los aspectos más llamativos de COVID-19 son las marcadas diferencias en las experiencias de la enfermedad. Algunas personas nunca desarrollan síntomas, mientras que otras, algunas aparentemente sanas, padecen neumonía grave o incluso mortal. “Las diferencias en el resultado clínico son dramáticas”, dice Kári Stefánsson, genetista y director ejecutivo de DeCODE Genetics en Reykjavik, cuyo equipo está buscando variantes de genes humanos que puedan explicar algunas de estas diferencias.
Uno de los aspectos más llamativos de COVID-19 son las marcadas diferencias en las experiencias de la enfermedad. Algunas personas nunca desarrollan síntomas, mientras que otras, algunas aparentemente sanas, padecen neumonía grave o incluso mortal. “Las diferencias en el resultado clínico son dramáticas”, dice Kári Stefánsson, genetista y director ejecutivo de DeCODE Genetics en Reykjavik, cuyo equipo está buscando variantes de genes humanos que puedan explicar algunas de estas diferencias.
El mayor misterio: lo que se necesita para rastrear la fuente del coronavirus
Esa búsqueda se ha visto obstaculizada por el número relativamente pequeño de casos en Islandia. Pero el mes pasado, un equipo internacional que analizó los genomas de aproximadamente 4.000 personas de Italia y España descubrió los primeros vínculos genéticos fuertes con COVID-19 1 severo . Las personas que desarrollaron insuficiencia respiratoria tenían más probabilidades de portar una de dos variantes genéticas particulares que las personas que no desarrollaban la enfermedad.
Una variante se encuentra en la región del genoma que determina el tipo sanguíneo ABO. El otro está cerca de varios genes, incluido uno que codifica una proteína que interactúa con el receptor que el virus usa para entrar en las células humanas, y otros dos que codifican moléculas vinculadas a la respuesta inmune contra patógenos. Los investigadores forman parte del COVID-19 Host Genetics Initiative, un consorcio global de grupos que están reuniendo datos para validar los hallazgos y descubrir más vínculos genéticos.
 (<– Imagen: Un sanitario ayuda a una persona de 21 años con COVID-19 a hablar con un familiar por videollamada en Bogotá. Crédito: Juan Barreto / AFP / Getty)
(<– Imagen: Un sanitario ayuda a una persona de 21 años con COVID-19 a hablar con un familiar por videollamada en Bogotá. Crédito: Juan Barreto / AFP / Getty)
Las variantes identificadas hasta ahora parecen desempeñar un papel modesto en el resultado de la enfermedad. Un equipo dirigido por Jean-Laurent Casanova, inmunólogo de la Universidad Rockefeller en la ciudad de Nueva York, está buscando mutaciones que tengan un papel más importante.
Para encontrarlos, su equipo está peinando los genomas completos de personas menores de 50 años sanas que han experimentado casos graves de COVID-19, dice, como “el tipo que corre un maratón en octubre y ahora, cinco meses después, está en UCI, intubado y ventilado ”. La extrema susceptibilidad a otras infecciones, incluida la tuberculosis y el virus de Epstein-Barr, un patógeno generalmente inofensivo que a veces causa enfermedades graves, se ha atribuido a mutaciones en genes individuales. Casanova sospecha que lo mismo será cierto para algunos casos de COVID-19.
¿Cuál es la naturaleza de la inmunidad y cuánto dura?
Los inmunólogos están trabajando febrilmente para determinar cómo podría ser la inmunidad al SARS-CoV-2 y cuánto tiempo podría durar. Gran parte del esfuerzo se ha centrado en «anticuerpos neutralizantes», que se unen a las proteínas virales y previenen directamente la infección. Los estudios han encontrado 2 que los niveles de anticuerpos neutralizantes contra el SARS-CoV-2 permanecen altos durante algunas semanas después de la infección, pero luego generalmente comienzan a disminuir.
Sin embargo, estos anticuerpos pueden permanecer en niveles altos durante más tiempo en personas que tienen infecciones particularmente graves. “Cuanto más virus, más anticuerpos y más durarán”, dice el inmunólogo George Kassiotis del Instituto Francis Crick de Londres. Se han observado patrones similares con otras infecciones virales, incluido el SARS (síndrome respiratorio agudo severo). La mayoría de las personas que tenían SARS perdieron sus anticuerpos neutralizantes después de los primeros años. Pero aquellos que lo tenían muy gravemente todavía tenían anticuerpos cuando se volvieron a probar 12 años después, dice Kassiotis.
[Artículo relacionado: ¿Cómo transmiten los niños el coronavirus? La ciencia aún no está clara]
Los investigadores aún no saben qué nivel de anticuerpos neutralizantes se necesita para combatir la reinfección por SARS-CoV-2, o al menos para reducir los síntomas de COVID-19 en una segunda enfermedad. Y otros anticuerpos pueden ser importantes para la inmunidad. El virólogo Andrés Finzi de la Universidad de Montreal en Canadá, por ejemplo, planea estudiar el papel de los anticuerpos que se unen a las células infectadas y marcarlas para su ejecución por parte de las células inmunitarias, un proceso llamado citotoxicidad celular dependiente de anticuerpos, en respuestas al SARS-CoV. -2.
En última instancia, es probable que una imagen completa de la inmunidad contra el SARS-CoV-2 se extienda más allá de los anticuerpos. Otras células inmunes llamadas células T son importantes para la inmunidad a largo plazo, y los estudios sugieren que el SARS-CoV-2 3 , 4 también las llama a las armas . “La gente equipara los anticuerpos con la inmunidad, pero el sistema inmunológico es una máquina maravillosa”, dice Finzi. «Es mucho más complejo que solo los anticuerpos».
Debido a que todavía no existe un marcador claro y mensurable en el cuerpo que se correlacione con la inmunidad a largo plazo, los investigadores deben reconstruir el mosaico de respuestas inmunes y compararlo con las respuestas a infecciones con otros virus para estimar cuán duradera podría ser la protección. Los estudios 5 de otros coronavirus sugieren que la ‘inmunidad esterilizante’, que previene la infección, podría durar solo unos meses. Pero la inmunidad protectora, que puede prevenir o aliviar los síntomas, podría durar más que eso, dice Shane Crotty, virólogo del Instituto de Inmunología de La Jolla en California.
[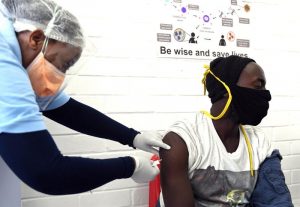 Imagen –> Un voluntario en Soweto, Sudáfrica, recibe una inyección en un ensayo clínico para una posible vacuna COVID-19. Crédito: Felix Dlangamandla / Beeld / Gallo Images / Getty]
Imagen –> Un voluntario en Soweto, Sudáfrica, recibe una inyección en un ensayo clínico para una posible vacuna COVID-19. Crédito: Felix Dlangamandla / Beeld / Gallo Images / Getty]
¿Ha desarrollado el virus alguna mutación preocupante?
Todos los virus mutan a medida que infectan a las personas y el SARS-CoV-2 no es una excepción. Los epidemiólogos moleculares han utilizado estas mutaciones para rastrear la propagación global del virus. Pero los científicos también están buscando cambios que afecten sus propiedades, por ejemplo, haciendo que algunos linajes sean más o menos virulentos o transmisibles. “Es un virus nuevo; si se volviera más severo, algo que deberíamos saber», dice David Robertson, biólogo computacional de la Universidad de Glasgow, Reino Unido, cuyo equipo está catalogando las mutaciones del SARS-CoV-2. Tales mutaciones también tienen el potencial de disminuir la efectividad de las vacunas, al alterar la capacidad de los anticuerpos y las células T para reconocer el patógeno.
Pero la mayoría de las mutaciones no tendrán ningún impacto y es un desafío identificar las más preocupantes. Las versiones del coronavirus identificadas al inicio de los brotes en puntos críticos como Lombardía en Italia o en Madrid, por ejemplo, pueden parecer más letales que las que se encuentran en etapas posteriores o en otros lugares. Pero estas asociaciones probablemente sean falsas, dice William Hanage, epidemiólogo de la Escuela de Salud Pública TH Chan de la Universidad de Harvard en Boston, Massachusetts: es más probable que los médicos identifiquen casos graves en etapas tempranas y no controladas de un brote. La amplia propagación de ciertas mutaciones también podría deberse a los ‘efectos fundadores’, en los que los linajes que surgen temprano en los centros de transmisión como Wuhan o el norte de Italia tienen una mutación que se transmite cuando siembran brotes en otros lugares.
[Artículo relacionado: Los ensayos de la vacuna contra el coronavirus han dado sus primeros resultados, pero su promesa aún no está clara]
Los investigadores debaten si la prevalencia generalizada de una mutación en la proteína de las espinas del virus es el producto de un efecto fundador, o un ejemplo de un cambio consecuente en la biología del virus. La mutación parece haber surgido por primera vez alrededor de febrero en Europa, donde la mayoría de los virus circulantes ahora la portan, y ahora se encuentra en todas las regiones del mundo. Una serie de estudios han sugerido que esta mutación hace que el virus SARS-CoV-2 sea más infeccioso para las células cultivadas, pero no está claro cómo esta propiedad se traduce en infecciones en humanos.
¿Cómo funcionará la vacuna?
Una vacuna eficaz podría ser la única forma de salir de la pandemia. Actualmente hay aproximadamente 200 en desarrollo en todo el mundo, con alrededor de 20 en ensayos clínicos. Los primeros ensayos de eficacia a gran escala para averiguar si funciona alguna vacuna están programados para comenzar en los próximos meses. Estos estudios compararán las tasas de infección por COVID-19 entre las personas que reciben una vacuna y las que reciben un placebo.
Pero ya hay pistas en datos de estudios en animales y ensayos en humanos en etapa temprana, principalmente pruebas de seguridad. Varios equipos han realizado «ensayos de desafío» en los que los animales que reciben una vacuna candidata se exponen intencionalmente al SARS-CoV-2 para ver si el pinchazo puede prevenir la infección. Los estudios en monos macacos sugieren que las vacunas podrían hacer un buen trabajo para prevenir la infección pulmonar y la neumonía resultante, pero no para bloquear la infección en otras partes del cuerpo, como la nariz. Los monos que recibieron una vacuna desarrollada por la Universidad de Oxford, Reino Unido, y luego fueron expuestos al virus tenían niveles de material genético viral en sus narices comparables a los niveles en animales no vacunados 7 . Resultados como este plantean la posibilidad de una vacuna COVID-19 que prevenga enfermedades graves, pero no la propagación del virus.
Los datos en humanos, aunque escasos, sugieren que las vacunas COVID-19 inducen a nuestros cuerpos a producir potentes anticuerpos neutralizantes que pueden impedir que el virus infecte las células. Lo que aún no está claro es si los niveles de estos anticuerpos son lo suficientemente altos como para detener nuevas infecciones o cuánto tiempo persisten estas moléculas en el cuerpo.
Con el gobierno y la industria invirtiendo miles de millones en el desarrollo, la prueba y la fabricación de vacunas, una vacuna podría estar disponible en un tiempo récord, dicen los científicos, simplemente podría no ser completamente efectiva. “Podríamos tener vacunas en la clínica que sean útiles para las personas dentro de los 12 o 18 meses”, dijo a Nature en mayo Dave O’Connor, virólogo de la Universidad de Wisconsin-Madison . «Pero vamos a necesitar mejorarlos».
 [<– Imagen: Los murciélagos de herradura son el principal sospechoso en la búsqueda del origen del coronavirus SARS-CoV-2. Crédito: Menahem Kahana / AFP / Getty]
[<– Imagen: Los murciélagos de herradura son el principal sospechoso en la búsqueda del origen del coronavirus SARS-CoV-2. Crédito: Menahem Kahana / AFP / Getty]
¿Cual es el origen del virus?
La mayoría de los investigadores están de acuerdo en que el coronavirus SARS-CoV-2 probablemente se originó en murciélagos , específicamente murciélagos de herradura. Este grupo alberga dos coronavirus estrechamente relacionados con el SARS-CoV-2. Uno, llamado RATG13, se encontró 8 en murciélagos de herradura intermedios (Rhinolophus affinis ) en la provincia de Yunnan, en el suroeste de China, en 2013. Su genoma es 96% idéntico al del SARS-CoV-2. La siguiente coincidencia más cercana es RmYN02, un coronavirus que se encuentra en murciélagos de herradura malayos (Rhinolophus malayanus ), que comparte el 93% de su secuencia genética con el SARS-CoV-2 9 .
Un análisis exhaustivo 10 de más de 1200 coronavirus muestreados de murciélagos en China también apunta a los murciélagos de herradura en Yunnan como el origen probable del nuevo coronavirus. Pero el estudio no excluye la posibilidad de que el virus provenga de murciélagos de herradura en países vecinos, incluidos Myanmar, Laos y Vietnam.
La diferencia del 4% entre los genomas de RATG13 y SARS-CoV-2 representa décadas de evolución. Los investigadores dicen que esto sugiere que el virus podría haber pasado a través de un huésped intermedio antes de propagarse a las personas, de la misma manera que se cree que el virus que causa el SARS pasó de los murciélagos en herradura a las civetas antes de llegar a las personas. Se presentaron algunos candidatos para este hospedador animal al principio del brote, y varios grupos se dirigieron a los pangolines 12 .
[Artículo relacionado: ¿Cómo mata el COVID-19? La incertidumbre está obstaculizando la capacidad de los médicos para elegir tratamientos]
Los investigadores aislaron coronavirus de pangolines malayos (Manis javanica ) confiscados durante operaciones contra el contrabando en el sur de China 11 , 12 . Estos virus comparten hasta el 92% de sus genomas con el nuevo coronavirus. Los estudios confirman que los pangolines pueden albergar coronavirus que comparten un ancestro común con el SARS-CoV-2, pero no prueban que el virus saltó de los pangolines a las personas.
Para rastrear inequívocamente el viaje del virus a las personas, los científicos necesitarían encontrar un animal que albergue una versión más del 99% similar al SARS-CoV-2, una perspectiva complicada por el hecho de que el virus se ha propagado ampliamente entre las personas, que incluso lo han pasado a otros animales, como gatos, perros y visones de granja.
Zhang Zhigang, un microbiólogo evolutivo de la Universidad de Yunnan en Kunming, dice que los esfuerzos de los grupos de investigación en China para aislar el virus de animales de granja o de vida salvaje, incluidas las civetas, han quedado al descubierto. Grupos en el sudeste asiático también están buscando el coronavirus en muestras de tejido de murciélagos, pangolines y civetas.
Referencias
- Elinghaus, D. y col. Preprint en medRxiv https://doi.org/10.1101/2020.05.31.20114991 (2020).
- Largo, Q.-X. et al. Nature Med . https://doi.org/10.1038/s41591-020-0965-6 (2020).
- Grifoni, A. et al. Cell 181 , 1489–1501 (2020).
- Ni, L. et al. Immunity 52 , 971–977 (2020).
- Callow, KA, Parry, HF, Sargento, M. y Tyrrell, DA Epidemiol. Infectar. 105 , 435-446 (1990).
- MacLean, OA y col. Preprint en bioRxiv https://doi.org/10.1101/2020.05.28.122366 (2020).
- van Doremalen, N. et al. Preimpresión en bioRxiv https://doi.org/10.1101/2020.05.13.093195 (2020).
- Zhou, P. y col. Nature 579 , 270–273 (2020).
- Zhou, H. y col. Curr. Biol. 30 , 2196–2203 (2020).
- Latinne, A. et al. Preprint en bioRxiv https://doi.org/10.1101/2020.05.31.116061 (2020).
- Lam, TT-Y. et al. Naturaleza https: // doi . org / 10.1038 / s41586-020-2169-0 (2020).
- Zhang, T., Wu, Q. y Zhang, Z. Curr. Biol. 30 , 1346-1351 (2020).