Una mujer se convierte en la primera persona en recibir un trasplante de riñón de cerdo y una bomba cardíaca.

La Inteligencia Artificial en el mundo de la salud
27/04/2024
INAUGURACIÓN Y PRESENTACIÓN DEL CONGRESO – D. Alfonso Bullón de Mendoza y Dª Alicia Latorre
25/06/2024Por Tanya Lewis. Publicado en Scientific American Daily Newsletter el 24 de abril de 2024.
Una mujer con una enfermedad cardíaca y renal potencialmente mortal se convirtió en la segunda persona en recibir un riñón de cerdo genéticamente modificado y la primera en recibir una bomba cardíaca y un órgano trasplantado juntos.
Las personas con insuficiencia cardíaca pueden ser elegibles para recibir un trasplante de corazón; las personas con insuficiencia renal pueden tener la suerte de recibir un trasplante de riñón. Pero para muchas personas con enfermedades cardíacas y renales (que pueden no ser elegibles para ser incluidas en la lista para un trasplante o no pueden recibir ambos órganos a tiempo) las opciones son extremadamente limitadas.
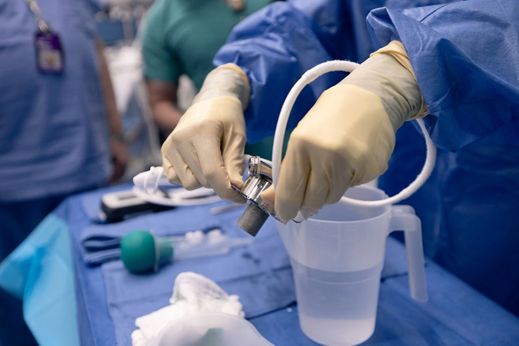
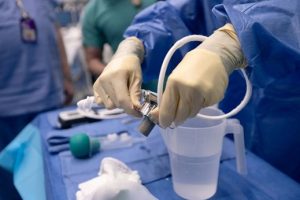
 Robert Montgomery, profesor y presidente del departamento de cirugía y director del Instituto Langone de Trasplantes de la Universidad de Nueva York, prepara el sitio quirúrgico para la cirugía de xenotrasplante para Lisa Pisano el 12 de abril de 2024. Joe Carrotta for NYU Langone Health
Robert Montgomery, profesor y presidente del departamento de cirugía y director del Instituto Langone de Trasplantes de la Universidad de Nueva York, prepara el sitio quirúrgico para la cirugía de xenotrasplante para Lisa Pisano el 12 de abril de 2024. Joe Carrotta for NYU Langone Health
Sin embargo, los científicos de NYU Langone Health en la ciudad de Nueva York han completado un procedimiento, el primero de su tipo, que implica una cirugía para instalar un dispositivo de asistencia ventricular izquierda (LVAD), o bomba cardíaca mecánica, seguido del trasplante de un riñón de cerdo genéticamente modificado. Es la primera vez que alguien con un LVAD recibe un trasplante de cualquier tipo (excepto un trasplante de corazón para reemplazar el dispositivo) y solo la segunda vez que se trasplanta un riñón de cerdo genéticamente modificado a una persona viva.
El logro crea una vía potencial para tratar a personas con enfermedades cardíacas y renales. «Nuestro éxito en este paciente abrirá muchas posibilidades para los miles de pacientes que tienen alguna combinación de problemas con el corazón y el riñón», dice Nader Moazami, jefe de la división de trasplantes de corazón y pulmón. y soporte circulatorio mecánico en la Facultad de Medicina Grossman de la Universidad de Nueva York, que realizó la cirugía del LVAD.
Existe una enorme demanda de trasplantes de riñón y de otro tipo, pero no hay suficientes órganos de donantes disponibles. Sin embargo, en los últimos años, los científicos han logrado avances significativos en el trasplante de órganos de especies no humanas a humanos, lo que se conoce como xenotrasplante.
A finales de marzo, los cirujanos del Hospital General de Massachusetts anunciaron que habían completado el primer trasplante de riñón de cerdo genéticamente modificado en una persona viva: un hombre de 62 años con una enfermedad renal terminal llamado Richard Slayman. Después de un episodio temprano de rechazo inmunológico, que fue tratado con éxito, Slayman fue dado de alta para vivir en su casa y se encuentra bien, según su equipo de trasplante.
La receptora de la reciente cirugía LVAD y xenotrasplante de riñón fue Lisa Pisano, una abuela de 54 años de Nueva Jersey que padecía insuficiencia cardíaca y enfermedad renal terminal y estaba en diálisis. Pisano no era elegible para recibir un trasplante de corazón y riñón humano porque tenía muchas contraindicaciones que habrían hecho improbable encontrar un órgano y sobrevivir al procedimiento, y su esperanza de vida era muy limitada. Su cirugía experimental se realizó bajo el programa de Acceso Ampliado de la Administración de Alimentos y Medicamentos de EE. UU., a veces denominado “uso compasivo”, una vía para personas que padecen una enfermedad grave con pocas opciones de tratamiento.
Primero, un equipo dirigido por Moazami implantó un LVAD en Pisano el 4 de abril. La mayoría de las personas que están en diálisis no son elegibles para recibir un LVAD porque existe una tasa de mortalidad muy alta en esas personas. Ahí es donde entró en juego el riñón xenotrasplantado.
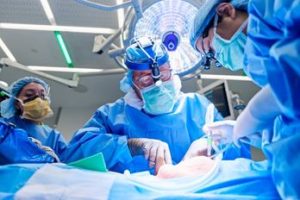
 El dispositivo de asistencia ventricular izquierda, o DAVI, está preparado para su implantación en Lisa Pisano el 4 de abril de 2024. Haley Ricciardi/Salud Langone de la Universidad de Nueva York.
El dispositivo de asistencia ventricular izquierda, o DAVI, está preparado para su implantación en Lisa Pisano el 4 de abril de 2024. Haley Ricciardi/Salud Langone de la Universidad de Nueva York.
El 12 de abril, un equipo dirigido por Robert Montgomery, presidente del departamento de cirugía y director del Instituto Langone de Trasplantes de la Universidad de Nueva York, trasplantó el riñón con un timo incrustado de un cerdo en Pisano. El cerdo había sido editado genéticamente para eliminar un gen que da como resultado la producción de un azúcar llamado alfa-gal, que puede desencadenar una respuesta inmune en el cuerpo humano que podría provocar que rechace un órgano del cerdo. La glándula timo se incluyó con la esperanza de que, en última instancia, pudiera reducir la cantidad de medicación inmunosupresora necesaria después del trasplante al entrenar al sistema inmunológico para que no atacara el riñón extraño.
El equipo tuvo que determinar el caudal correcto de la bomba cardíaca para permitir que el riñón trasplantado funcionara eficazmente. Sin embargo, tan pronto como lo hicieron, el órgano comenzó a producir orina y creatinina, un producto de desecho clave que se supone que los riñones deben eliminar. «Había cosas que teníamos que aprender porque no se habían hecho antes», dice Montgomery.
Hubo algunas diferencias importantes entre el xenotrasplante Langone de la Universidad de Nueva York y el anterior en Mass General. «Hay básicamente dos formas posibles de pensar cómo los xenotrasplantes pueden ayudar a los pacientes», dice Leonardo Riella, presidente de trasplantes y director médico de trasplante de riñón en Mass General, quien ayudó a dirigir el equipo que realizó el trasplante de riñón de cerdo anterior. Por otro lado, tenemos los candidatos a trasplante de riñón que están en lista de espera, que lamentablemente no tienen donante, pero han sido aprobados para recibir un trasplante de riñón humano”, dice. Ese fue el caso del receptor del xenotrasplante de su equipo, Slayman. La otra forma en que el xenotrasplante podría ayudar, dice Riella, es con “un paciente que no es candidato para un trasplante de órgano humano pero [a quien se le ofrece] el xenotrasplante como posible último recurso”, como fue el caso de Pisano.
Pisano probablemente estaba mucho más enfermo que Slayman, dice Riella. A diferencia de Slayman, ella no era elegible para un trasplante de órgano humano y también tenía insuficiencia cardíaca y renal, mientras que él solo tenía insuficiencia renal. «Hay valores en ambos [tipos de cirugía]», dice Riella. Sin embargo, “hacerlo con un paciente que no es candidato a trasplante [de órgano humano] suele conllevar un mayor riesgo”.
Además, Pisano recibió un órgano de un cerdo que sólo había tenido una modificación genética, mientras que Slayman recibió uno de un animal con 69 ediciones genéticas. Queda por ver si estas ediciones adicionales son necesarias para la supervivencia a largo plazo de estos órganos xenotrasplantados en las personas.
Pisano hasta el momento no ha mostrado signos de rechazo inmunológico agudo. Sin embargo, el punto crítico para esto puede llegar alrededor de un mes después de la cirugía, dice Montgomery. Por ahora, él y sus colegas continúan vigilándola de cerca.
«Creo que es increíblemente emocionante que ahora tengamos un segundo riñón de cerdo genéticamente modificado que se haya implantado en una persona viva», afirma Jayme Locke, directora de la división de trasplantes y catedrática de cirugía de trasplantes de la Universidad de Alabama en Birmingham, cuyo equipo ha realizó trasplantes de riñón de cerdo previos en humanos que habían sufrido muerte cerebral. “Como con cualquier otro trasplante, en los primeros días queremos asegurarnos de que tenemos el control del sistema inmunológico y que no hay rechazos tempranos”, dice. «Si esto funciona, será increíblemente positivo».
Los dos xenotrasplantes de riñón recientes proporcionarán a los científicos conocimientos valiosos sobre la seguridad y eficacia del procedimiento. Pero tanto el equipo de NYU Langone como el de Mass General señalan que los ensayos clínicos en un grupo más grande de personas son un siguiente paso importante antes de que los xenotrasplantes puedan convertirse en un tratamiento aprobado y ayudar a abordar la inmensa necesidad de órganos.
En cuanto a Pisano, Montgomery dice que conocía los riesgos del procedimiento, pero sintió que valía la pena por la posibilidad de prolongar su vida. “Ella sabía que iba a morir y que no tenía mucho tiempo”, afirma. “Desde el principio, ella dijo: ‘Quiero pasar tiempo con mis nietos y tener más tiempo’”.