¿El trasplante de corazón de cerdo a humano abre un nuevo horizonte?
Las células inmunitarias T “killers” todavía reconocen la variante de Omicron
13/01/2022
Desafíos actuales de la Bioética (on line, ZOOM, sábado 15 enero)
14/01/2022 Por Julio Tudela, Observatorio de Bioética, Instituto Ciencias de la Vida, Universidad Católica de Valencia, y Nicolás Jouve, Catedrático Emérito de Genética, Departamento de Biomedicina y Biotecnología, Universidad de Alcalá. Publicado en Observatorio de Bioética de la UCV el 13 de enero de 2022.
Por Julio Tudela, Observatorio de Bioética, Instituto Ciencias de la Vida, Universidad Católica de Valencia, y Nicolás Jouve, Catedrático Emérito de Genética, Departamento de Biomedicina y Biotecnología, Universidad de Alcalá. Publicado en Observatorio de Bioética de la UCV el 13 de enero de 2022.
Un paciente de EEUU, afectado de una cardiopatía grave para el que no existía alternativa terapéutica, se ha sometido a un trasplante recibiendo un corazón de cerdo.
Desde finales del pasado siglo, la ciencia relacionada con los trasplantes ha buscado alternativas al trasplante de órganos humanos, explorando la posibilidad de utilizar órganos de animales modificados genéticamente. Un paso adelante en esta carrera son los experimentos del científico español Juan Carlos Izpisua encaminados a la creación de híbridos o quimeras humano-animales, de las cuales pudieran extraerse órganos para ser utilizados en clínica humana. Esencialmente consistieron, en un primer paso, en inyectar células troncales embrionarias humanas en embriones de ratones para que en ellos se pudieran generar órganos cuasi humanos, con la finalidad última de que pudieran ser utilizados para trasplantes en la clínica humana, experiencias que fueron publicadas en la revista Nature . Posteriormente, nuevos experimentos de Izpisua han logrado modificar embriones de cerdo y, posteriormente, de primates, inoculándoles células troncales humanas genéticamente modificadas para obtener órganos animales “humanizados” susceptibles de ser trasplantados a humanos. Como ya se comentó en un Informe publicado en el Observatorio de Bioética, por parte de los bioeticistas Aznar, Tudela y Gómez Tatay , estas experiencias plantean objetivos problemas bioéticos, que resumidamente podrían centrarse en: a) en algunas de dichas experiencias se utilizaron células troncales de embriones humanos; b) no estaba totalmente controlado que las células humanas implantadas al animal no pudieran colonizar otros órganos distintos al que se pretende producir; c) que incluso dicha colonización podría alcanzar el cerebro humano o los órganos reproductores, lo que añadiría una dificultad bioética adicional; d) la amenaza de los límites conceptuales, sociales y morales que distinguen a los seres humanos de otras criaturas; y d) cuestiones de bioseguridad y bienestar animal.
Un nuevo horizonte
Pero ahora, se abre un nuevo horizonte en el campo de los trasplantes consistente en trasplantar directamente órganos de animales modificados genéticamente al paciente que lo requiere y no un órgano humano-animal producido para dicha finalidad.
Estos xenotrasplantes, que es como se denominan, vienen siendo estudiados desde hace décadas. El principal problema que presenta esta línea de investigación es la dificultad para controlar el rechazo inmunológico del receptor, máxime cuando el órgano trasplantado pertenece a otra especie animal. En este sentido, el pasado 25 de septiembre de 2021 se trasplantó con éxito relativo un riñón de cerdo modificado genéticamente a una mujer en muerte cerebral que funcionó correctamente durante 54 horas, (ver aquí) trasplante que, el nefrólogo Rafael Matesanz, fundador de la Organización Nacional de Trasplantes de España, calificó como una “experiencia fascinante porque, al menos a corto plazo, la modificación genética introducida ha permitido salvar la barrera interespecies, algo que se persigue desde hace décadas”, pero que sin embrago sigue planteando algún problema bioético tal y como comenta Matesanz, ya que “ofrecer un riñón de cerdo a una persona está manifiestamente por debajo del estándar”. Por otra parte, también habría que considerar que la autorización para realizar el ensayo no fue dada por la paciente trasplantada, sino por su familia, al considerar que a ella —donante y amiga de personas con insuficiencia renal sometidas a diálisis— le habría encantado participar en dicho ensayo.
Recientemente, ha sido difundida en medios de comunicación la noticia de un nuevo xenotrasplante realizado en la Facultad de Medicina de la Universidad de Maryland (EEUU). En esta ocasión se ha trasplantado, también con éxito relativo, un corazón de cerdo a un paciente afectado de una cardiopatía grave para el que no existía alternativa terapéutica. La intervención fue autorizada como uso compasivo, es decir, cuando no se dispone de las evidencias de seguridad y eficacia suficientes, pero no existe otra alternativa para tratar de salvar la vida del paciente.
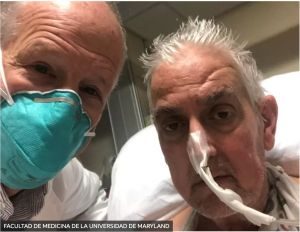
<– En la foto el cirujano Bartley Griffith junto al paciente David Bennett a inicios de enero.
Este trasplante fue posible solo después de que el animal del que procede el corazón fuese modificado genéticamente, alterando 10 genes de los cuales tres de ellos están relacionados con el rechazo inmunológico por parte del receptor, uno de ellos limita el sobrecrecimiento del propio órgano y seis genes más, de procedencia humana, fueron introducidos en el animal, con el fin también de aminorar el previsible rechazo inmunológico. Así, han demostrado por primera vez que un corazón animal modificado genéticamente puede funcionar en un paciente sin un rechazo inmediato por parte del receptor. En esta ocasión el consentimiento para dicha intervención sí fue otorgado por el propio paciente, al cual se le informó de los riesgos de la operación al tratarse de una técnica todavía experimental.
Se sigue avanzando en la carrera por buscar soluciones a la falta de órganos para trasplantes y estas técnicas podrían ayudar a solventar este problema en un futuro no próximo, debido a las numerosas dificultades que entraña tanto el rechazo inmunológico interespecies como la funcionalidad de órganos muy diferentes en algunos casos, como el riñón.
Valoración bioética
 Además de los riesgos ya expuestos acerca de la imposibilidad de controlar la proliferación de células humanas en organismos animales, tal como ocurre en la producción de híbridos, los experimentos más recientes de xenotrasplante no presentan más dificultad ética que la de la seguridad del procedimiento, su viabilidad a más largo plazo y los efectos secundarios que pudieran derivarse de la utilización de órganos y tejidos genéticamente modificados proceden de especies animales, con el posible riesgo de zoonosis provocada por transmisión de virus animales al receptor humano. Las incógnitas son muchas y solo una experimentación prudente, con una adecuada evaluación de los riesgos y consecuencias de estos procesos, abrirá el camino a un verdadero avance en el campo de la medicina de trasplantes.
Además de los riesgos ya expuestos acerca de la imposibilidad de controlar la proliferación de células humanas en organismos animales, tal como ocurre en la producción de híbridos, los experimentos más recientes de xenotrasplante no presentan más dificultad ética que la de la seguridad del procedimiento, su viabilidad a más largo plazo y los efectos secundarios que pudieran derivarse de la utilización de órganos y tejidos genéticamente modificados proceden de especies animales, con el posible riesgo de zoonosis provocada por transmisión de virus animales al receptor humano. Las incógnitas son muchas y solo una experimentación prudente, con una adecuada evaluación de los riesgos y consecuencias de estos procesos, abrirá el camino a un verdadero avance en el campo de la medicina de trasplantes.
La idea inicial de modificar genéticamente animales, particularmente cerdos, partió del genetista George Chrurch, y su colaborador Luhan Yang, líder de la llamada Biología sintética de la Universidad de Harvard que en 2017 fundó la startup eGenesis, con el fin de modificar genéticamente cerdos por medio de la técnica de edición genómica CRISPR para evitar que los órganos xenotrasplantados procedentes de estos animales fueran rechazados por el receptor humano. La modificación se realizó en embriones de cerdo y en diferentes investigaciones se llegaron a modificar hasta 60 genes diferentes, más que en ningún otro tipo de aplicación de la tecnología CRISPR realizada con anterioridad [1].
Para este proyecto, Church y Yang habían utilizado una línea de células de riñón de cerdo “inmortales”, elegidas por su capacidad para sobrevivir y dividirse indefinidamente en el laboratorio. Para hacer cerdos libres de virus (PERV), necesitaban comenzar con células genéticamente normales directamente de un cerdo vivo. Luego, en colaboración con investigadores daneses y chinos, el equipo de eGenesis aplicó el sistema CRISPR a células derivadas del tejido conectivo de fetos de cerdo. Esas células demostraron ser más frágiles cuando se sometieron al trabajo de edición con CRISPR: una vez editadas, no crecieron normalmente, posiblemente porque el daño a su ADN hizo que dejaran de dividirse o se autodestruyeran, según comunicó Yang. Pero al exponer las células a un cóctel químico que fomentó el crecimiento y reprimió un gen clave que suprime el crecimiento, el equipo aumentó al 100 % la porción de células libres de PERV en los cultivos celulares.
Para producir los lechones, los investigadores utilizaron una técnica de clonación estándar: insertaron los núcleos que contenían ADN de estas células editadas en óvulos extraídos de los ovarios de cerdos en un matadero chino. Permitieron que cada óvulo se convirtiera en un embrión y lo implantaron en el útero de una madre sustituta [2] (ver más).
Ya en la fase adulta, los cerdos derivados serían utilizados para los xenotrasplantes.
Hasta el momento, todos los ensayos de trasplante de los órganos modificados genéticamente se habían hecho con modelos animales en monos en el Massachusetts General Hospital por el cirujano James Marckmann. Pero sobre todo, el gran riesgo a tener en cuenta en su aplicación al hombre, además de las consideraciones éticas indicadas anteriormente, es el de la seguridad en el sentido de evitar la transmisión de virus animales a los receptores humanos.
Referencias
[1] Reardon, S. “Gene-editing record smashed in pigs” Nature oct 2025: https://doi.org/10.1038/nature.2015.18525
[2] Servick, K. CRISPR slices virus genes out of pigs, but will it make organ transplants to humans safer? Science aug 2017 https://www.science.org/content/article/crispr-slices-virus-genes-out-pigs-will-it-make-organ-transplants-humans-safer