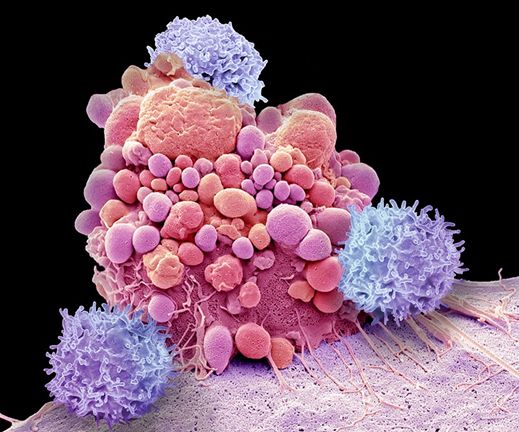
CAR-T. La terapia de último recurso contra el cáncer frena la enfermedad durante más de una década.

Más de 140 asociaciones manifiestan en el Senado su rechazo a la nueva Ley que penaliza las concentraciones Provida frente a las clínicas abortivas.
04/02/2022
LIBRO ¡DESPERTAD! TRANSHUMANISMO Y NUEVO ORDEN MUNDIAL. Autor: Albert Cortina.
04/02/2022Por Heidi Ledford. Publicado en Nature, el 2 de febrero de 2022 (Fotografia de portada: La terapia con células CAR-T modifica las células T, que se muestran aquí atacando una célula de cáncer cerebral, para reconocer proteínas específicas. Crédito: Steve Gschmeissner/Science Photo Library)
Dos de las primeras personas tratadas con terapias de cáncer de células CAR-T todavía están en remisión después de 12 años.
Unas semanas después de recibir una terapia experimental contra el cáncer que convierte a las células inmunitarias en cazadores de tumores, el médico de Doug Olson se sentó con él para informarle sobre su progreso. «Él dijo: ‘Doug, no podemos encontrar una sola célula cancerosa en tu cuerpo'», recuerda Olson. “Estaba bastante convencido de que había terminado con el cáncer”.
Sin embargo, los médicos de Olson no estaban tan seguros. Corría el año 2010 y Olson fue una de las primeras personas con leucemia linfocítica crónica en recibir el tratamiento, llamado terapia de células CAR-T. Cuando sus médicos, incluidos Carl June y David Porter de la Universidad de Pensilvania en Filadelfia, escribieron el protocolo para el ensayo clínico en el que participó Olson, esperaban que las células modificadas genéticamente pudieran sobrevivir durante un mes en su cuerpo. Sabían que la investigación del cáncer podía ser desgarradora; no se atrevían a esperar una cura.
Pero más de diez años después, las células inmunitarias continúan patrullando la sangre de Olson y permanece en remisión. June finalmente está lista para admitir lo que Olson sospechó todo el tiempo. «Ahora podemos concluir que las células CAR T pueden realmente curar a los pacientes con leucemia», dijo June a los periodistas en una rueda de prensa en la que describió los resultados que se publicaron en Nature el 2 de febrero [1].
Destructores de tumores
Las terapias con células CAR-T implican eliminar células inmunitarias llamadas células T de una persona con cáncer y alterarlas genéticamente para que produzcan proteínas, llamadas receptores de antígenos quiméricos o CAR, que reconocen las células cancerosas. Luego, las células se reinfunden en la persona, con la esperanza de que busquen y destruyan los tumores.
En los años transcurridos desde el tratamiento de Olson, la Administración de Alimentos y Medicamentos de EE. UU. ha aprobado cinco terapias con células CAR-T para tratar leucemias, linfomas y mielomas. June estima que decenas de miles de personas han recibido tratamiento con células CAR-T.
RELACIONADO: Construyendo mejores terapias CAR-T
Pero la terapia es cara, arriesgada y técnicamente exigente. Sigue siendo el último recurso, para ser utilizado cuando todos los demás tratamientos han fallado. A pesar del éxito del tratamiento para Olson, no todos experimentan una remisión duradera de su cáncer. Al principio, solo alrededor del 25-35 % de los receptores de células CAR-T con leucemia linfocítica crónica experimentaron una remisión completa de su cáncer, dice Porter. Con el refinamiento, ese porcentaje ha aumentado a lo largo de los años, dice, pero algunos de estos éxitos iniciales aún conducen a una recaída. El seguimiento del tratamiento a largo plazo podría revelar pistas sobre qué factores son importantes para el éxito duradero de las células CAR-T.
Durante más de diez años, Porter y sus colegas analizaron las células CAR-T en Olson y otra persona tratada en 2010, rastreando la evolución de las células y buscando signos de problemas de seguridad.
Encontraron que las células CAR T persistieron, pero las características de la población cambiaron con el tiempo. Poco después de la infusión, surgió una población prominente de células T denominadas células CD8+. Estas a veces se denominan células T asesinas y pueden identificar y destruir células que muestran proteínas inusuales, como células cancerosas o células infectadas con un virus.
Pero a lo largo de los años, un tipo diferente de célula CAR T se volvió dominante. Las células T CD4+ pueden asumir una variedad de funciones en el sistema inmunitario, pero los investigadores demostraron que ambos participantes del estudio tenían células CD4+ con características que sugerían que serían capaces de matar células leucémicas.
Impacto tremendo
Olson y otro participante no tienen signos de leucemia en el momento presente. No está claro si las células CAR T mataron a todas las células leucémicas poco después de que se introdujeron, o si las células que continúan patrullando pueden destruir cualquier célula leucémica antes de que alcancen niveles detectables.
 RELACIONADO: Los cánceres altamente mutados responden mejor a la inmunoterapia
RELACIONADO: Los cánceres altamente mutados responden mejor a la inmunoterapia
“El impacto potencial de CAR T es tremendo”, dice Nirali Shah, hematóloga pediátrica del Instituto Nacional del Cáncer de EE.UU. en Bethesda, Maryland. Este estudio “le brinda una prueba de concepto sobre la seguridad de tener una persistencia e integración a largo plazo de las células T en su cuerpo”.
Queda por ver, agrega, cómo se traducirán los hallazgos de estos dos individuos con leucemia linfocítica crónica a otras enfermedades. Se están realizando esfuerzos para utilizar enfoques de células CAR-T para tratar tumores sólidos, como los tumores de próstata y el devastador glioblastoma del cáncer de cerebro. En enero, los investigadores informaron sobre el éxito en el uso de las células para destruir tejido cicatricial en el corazón, un enfoque que algún día podría usarse para tratar la fibrosis cardíaca [2]
En los años posteriores a su tratamiento, Olson volvió a su carrera en diagnóstico médico. Se comprometió a mantenerse saludable y su hijo lo convenció de correr medias maratones. “Si mi cáncer hubiera desaparecido, ciertamente no quería morir de un ataque al corazón”, dice. Eventualmente, decidió hacer pública la historia de su recuperación y servir como mentor para otras personas con cáncer.
Él trata de darles esperanza, dice: «Si no hay una cura para su cáncer hoy, hay una posibilidad razonable de que a la vuelta de la esquina, habrá una».
doi: https://doi.org/10.1038/d41586-022-00241-0
Referencias
[1] Melenhorst, J. J. et al. Nature https://doi.org/10.1038/s41586-021-04390-6 (2022).2.
{2} Rurik, J. G. et al. Science 375, 91–96 (2022).