Del borrador del Genoma Humano al final de la COVID-19

Tres naves en Marte
15/02/2021
Pedir, o echar una mano
28/02/2021P or Nicolás Jouve, Catedrático Emérito de Genética. Presidente de CíViCa. Vocal del Comité de Bioética de España. Publicado en Actuall el 17 de febrero de 2021.
or Nicolás Jouve, Catedrático Emérito de Genética. Presidente de CíViCa. Vocal del Comité de Bioética de España. Publicado en Actuall el 17 de febrero de 2021.
El Proyecto Genoma Humano (PGH) daba paso a una nueva etapa de la Biología al permitir estudiar el genoma de cualquier otra especie. Los avances en la tecnología molecular han contribuido de forma directa para el desarrollo de las “vacunas genéticas” de ARN mensajero contra la COVID-19.
En los años setenta, con una tecnología aún precaria, empezó a gestarse la idea de abordar el estudio de la información completa de nuestro genoma. Se partía de dos avances significativos. Por un lado, se sabía cómo aislar regiones del ADN del genoma de cualquier especie y cómo clonarlas (multiplicarlas) en el laboratorio. Por otro lado, en 1975 se publicaban las primeras técnicas de secuenciación del ADN, que hacían posible la lectura de las bases que constituyen los escalones de la molécula de la doble hélice, es decir el mensaje de los genes. El primer impulso en esa dirección tuvo lugar en la localidad de Alta, en Utah EE. UU., en 1984 en una reunión científica de los más importantes genetistas moleculares. Allí se decidió poner en marcha un proyecto de lectura de nuestro genoma que abriría las puertas al conocimiento de las causas de muchas enfermedades, cómo diagnosticarlas, e incluso cómo abordar su tratamiento.
Pero, además, dada la universalidad de la molécula de la vida y de su sistema de codificación, el Proyecto Genoma Humano (PGH) daba paso a una nueva etapa de la Biología al permitir estudiar el genoma de cualquier otra especie, con infinitas aportaciones al conocimiento sobre el origen, las relaciones filogenéticas y la evolución del gran abanico de las formas de vida.
Los trabajos experimentales del proyecto comenzaron en 1990, con el impulso entre otros de James Watson, codescubridor junto a Francis Crick de la estructura molecular del ADN, que consideró que acometer el PGH era un reto necesario y muy superior en sus aplicaciones al del éxito logrado por la NASA al llevar un hombre a la Luna, a cuyo empeño el gobierno de los EE.UU. había destinado un gran presupuesto.
En 1990, se creó el Centro Nacional de Investigación del Genoma Humano, ahora denominado Instituto Nacional de Investigación del Genoma Humano (NHGRI), que unió a estadounidenses e investigadores de otros países para lanzar el PGH.
El Proyecto Genoma Humano ha resultado ser un manantial de grandes aportaciones para la Biología y la Medicina
En febrero de 2001, hace por tanto veinte años, se publicaba un “borrador” del genoma humano. Este esqueleto del genoma sirvió de base para añadir los detalles que faltaban hasta completar la secuencia total de los 3.175 millones de pares de bases, en abril de 2003.
Desde entontes, los beneficios del PGH han sido numerosos y han devuelto con creces a sus impulsores la expectativa ilusionante del reto que se impusieron, a pesar de la ardua labor de coordinación y el elevado coste que supondría en aquel momento, en cualquier caso, diez veces inferior a la hazaña del Apolo 11.
El PGH ha resultado ser un manantial de grandes aportaciones para la Biología y la Medicina, especialmente al permitir desarrollar nuevos modos de abordar grandes proyectos de investigación. Entre las principales contribuciones se puede señalar el lanzamiento de un nuevo modo de investigar basado en la apertura y la cooperación entre decenas de laboratorios y miles de investigadores a través de consorcios internacionales. Además, se desarrollaron nuevas tecnologías y se impulsaron nuevas hipótesis para abordar múltiples investigaciones gracias a los canales de colaboración y el intercambio de datos, según se iban conociendo los detalles del genoma. Estos esfuerzos cristalizaron en el innovador “Acuerdo de las Bermudas” de 1996, en que se concertó la puesta en común de conjuntos de secuencias del genoma en una base pública de datos tan solo 24 horas después de su generación. También se impulsó la bioinformática y se crearon plataformas muy potentes que están permitiendo el uso de la computación y la creación de los biobancos en la investigación biomédica.
En los últimos años, han surgido grandes proyectos siguiendo el modelo del PGH, como el Atlas del Genoma del Cáncer, el Proyecto 1000 Genomas, el proyecto Enciclopedia de Elementos del ADN (ENCODE), o la Iniciativa de Investigación del Cerebro a través del Avance de Neurotecnologías Innovadoras (BRAIN).
Desde el inicio del PGH, se entendió que la información obtenida de la localización y secuenciación del genoma humano podría tener profundas implicaciones sociales y éticas. Se tuvo en cuenta que los datos genéticos humanos son datos sensibles que requieran proteger la privacidad de las personas, prevenir la discriminación y adoptar medidas de carácter ético, por lo que se creó el proyecto E.L.S.I. (Ethical, Legal and Social Implications), una iniciativa sin precedentes en las investigaciones biomédicas al que se destina el mayor presupuesto dedicado nunca a cuestiones bioéticas.
Desde la publicación del borrador en febrero de 2001 el número de genes humanos descubiertos (o «anotados») ha crecido enormemente. Desde 2001, se fueron publicando cerca de 20.000 artículos anuales sobre genes codificadores de proteínas, hasta que la cifra de los genes humanos quedaba estabilizada en torno a unos 20.000, muy por debajo de la estimación de los 100.000 supuestos al inicio del PGH. Entre ellos destacan muchos de los genes implicados en enfermedades, pero también de regiones del genoma no codificantes, pseudogenes, ADN repetitivo y zonas implicadas en la regulación de la expresión génica, en las que se encuentran involucradas moléculas de ARN no codificante.
Las aplicaciones más inmediatas del PGH se han dirigido a tres campos de importancia biomédica: el diagnóstico, el terapéutico y el farmacológico. El conocimiento de la secuencia de cerca de 3.000 genes implicados en enfermedades monogénicas, unas 150 regiones del genoma implicadas en cáncer y unas 1.200 regiones implicadas en enfermedades complejas, constituyen un gran balance para desarrollar protocolos de diagnóstico (incluidas las técnicas de identidad), terapia génica y predicción de la respuesta a fármacos.
Francis Collins, el médico-genetista líder desde el principio del consorcio internacional del PGH y actual Director de los NIH (National Institute of Health) decía a la culminación del PGH en abril de 2003: «La identificación de los genes responsables de las enfermedades humanas, que alguna vez fue una tarea hercúlea que requirió grandes equipos de investigación, muchos años de arduo trabajo y un resultado incierto, ahora se puede lograr de manera rutinaria en unas pocas semanas por un solo estudiante graduado con acceso a una conexión de Internet a las bases de datos públicas del genoma, una máquina de PCR y un secuenciador de ADN». Y en su libro El Lenguaje de Dios añadía: «Pronto llegará el momento en que serán descubiertas las alteraciones genéticas que colocan a cada uno de nosotros en riesgo de una cierta enfermedad futura, y podremos cada uno tener la oportunidad de desvelar qué hay oculto en el ADN de nuestro propio libro de instrucciones».
Y ahí es donde nos encontramos ahora, al conmemorar los veinte años del borrador del PGH, conocemos además el genoma de miles de especies y estamos en condiciones de encarar con optimismo los desafíos de muchas enfermedades, y entre ellas la sorprendente pandemia de la COVID-19.
Gracias a la genómica se demuestra la absurda afirmación de que el nuevo coronavirus que causa la COVID-19 es el producto de un diseño en un laboratorio de ingeniería genética
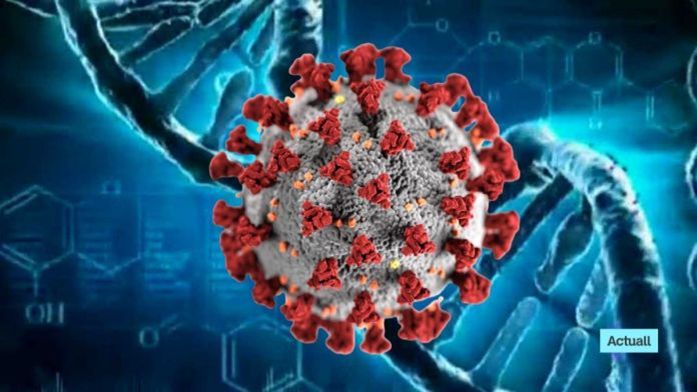
Hoy, en plena era de la “genómica” sabemos cómo actúan nuestros genes. Hemos aprendido que existen redes de interacción entre ellos o, mejor aún, entre sus productos de expresión, las proteínas, lo que constituye el campo de estudio de la llamada “interactómica”. Los avances del PGH ofrecen una vía metodológica para identificar fármacos reutilizables para tratar distintas enfermedades. Así, ante la COVID-19, se investigan fármacos eficaces para otras patologías. Se prueban fármacos que intervienen sobre proteínas humanas, aunque no estén directamente involucradas en el SARS-CoV-2. Además del Remdesivir hay un gran interés en probar de entre otros antivirales, anticoagulantes y otros fármacos de demostrada eficacia para otras infecciones, cuáles podrían utilizarse contra la COVID-19.
Además, la estela de conocimientos y las nuevas tecnologías que se han ido desarrollando al rebufo del PGH han contribuido al conocimiento del origen de la pandemia provocada por el SARS-CoV-2 y el medio de encarar con eficacia el bloqueo de la expansión de este coronavirus con vacunas eficaces y seguras.
Gracias a la genómica se demuestra la absurda afirmación de que el nuevo coronavirus que causa la COVID-19 es el producto de un diseño en un laboratorio de ingeniería genética, intencionadamente liberado para causar una pandemia. Hay incluso quien duda sobre el conocimiento del genoma del virus. ¿Cómo se puede negar que se haya secuenciado un genoma de poco menos de 30.000 bases nucleotídicas de ARN veinte años después de secuenciar un genoma de más de 3.000 millones de pares de bases de ADN? La secuencia completa del genoma del SARS-CoV-2 se publicó en febrero de 2020.
El nuevo virus no es el producto de una manipulación intencionada sino de mutaciones adaptativas a partir del genoma de otro coronavirus
Tras ello, un equipo internacional liderado por el investigador Kristian Andersen, aplicó herramientas bioinformáticas desarrolladas gracias al PGH, para comparar los datos genómicos disponibles públicamente de múltiples coronavirus, incluido el SARS-CoV-2 y así se desveló el verdadero origen de este virus. Los datos genómicos del coronavirus causante del COVID-19 muestran que su proteína de la espícula (S) contiene unas adaptaciones únicas para unirse a una proteína específica de las células humanas relacionada con la angiotensina (ACE2). Lo que los investigadores encontraron es que la proteína S del SARS-CoV-2 se une mucho mejor a ACE2 que lo haría cualquier producto de ingeniería genética tras un diseño informático.
El nuevo virus no es el producto de una manipulación intencionada sino de mutaciones adaptativas a partir del genoma de otro coronavirus. Los cientos de genomas de diferentes cepas del SARS-CoV-2 que se han secuenciado hasta la fecha demuestran que este virus tiene una capacidad moderada de mutación gracias a un sistema eficaz de reparación, pero en cualquier caso suficiente para dar lugar a variantes de diversa capacidad infectiva, como lo demuestran las cepas del Reino Unido, Brasil y Sudáfrica que han irrumpido en el panorama de la pandemia mundial en las últimas semanas.
Por último, también es de resaltar el hecho de que los avances en la tecnología molecular derivada del PGH ha contribuido de forma directa a un nuevo enfoque para el desarrollo de las innovadoras “vacunas genéticas” de ARN mensajero contra la COVID-19. Se ha demostrado que una vez que se conoce el genoma del agente infeccioso, se pueden producir vacunas en un tiempo récord y sin necesidad de añadir coadyuvantes ni conservantes. Como vimos en nuestro anterior artículo Un sí a la vacunación contra la COVID-19: las «vacunas genéticas« las empresas biotecnológicas de ‘Pfizer-NBiotech’ y ‘Moderna’, han conseguido unas vacunas que, tras unos ensayos acelerados por las circunstancias, que han sido aprobadas por su calidad, eficacia y seguridad por la Organización Médica Mundial y las agencias americana y europea del medicamento. Unas vacunas en que hoy está depositada la esperanza de acabar con una pandemia que ha provocado la muerte de cerca de dos millones y medio de personas en todo el mundo.